初中化学元素基础知识
推荐文章
作为初中最后一门接触的学科:化学,总是给人一种神秘的感觉。初步接触化学这个学科,会有很多的概念和知识点需要记忆和理解,有些同学可能会觉得枯燥无味。下面是小编给大家带来的初中化学元素基础知识,欢迎大家阅读参考,我们一起来看看吧!
初中化学知识点:元素周期表
元素周期表的创始人:
德米特里·伊万诺维奇·门捷列夫(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
概念:
根据元素的原子结构和性质,将已知的100多种元素按原子序数(数值上等于核电荷数)科学有序地排列起来所得的表,叫元素周期表。在周期表中,用不同的颜色对金属元素、非金属元素做了分区。
◎ 元素周期表的知识扩展
a)定义:根据元素的原子结构和性质,把它们科学有序的排列起来就得到了元素周期表。
b)元素周期表的结构:如:

(1)周期表每一横行叫做一个周期,共有7个周期
(2)周期表每一个纵行叫做一族,共有16个族(8、9、10三个纵行共同组成一个族)
c)元素周期表的意义
(1)学习和研究化学知识的工具
(2)为寻找新元素提供了理论依据
(3)由于在元素周期表中位置越靠近的元素,性质越相似,可以启发人们在元素周期表的
一定区域寻找新物质(如农药,催化剂,半导体材料)
元素周期表的结构:
①每一横行(周期):元素周期表每一横行叫做一个周期.共有7个横行,即7个周期。每个周期开头是金属元素(第一周期除外),靠近尾部是非金属元素,结尾的是稀有气体元素。同一周期元素的原子具有相同的电子层数。
②每一纵行(族):元素周期表共有18个纵行,每一个纵行叫做一个族(第8,9,10三个纵行共同组成一个族),共有16个族。
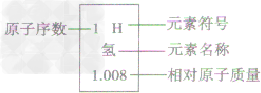
③每一格:在元素周期表中,每一种元素均占据一格。对于每一格,均包含元素的原子序数、元素符号、元素名称、相对原了质量等内容,如下图所示:
元素周期表的意义及应用:
①是学习和研究化学的重要工具。
②为寻找新元素提供了理论依据。
③由于元素周期表中位置靠近的元素性质相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、农药、催化剂等)。
元素周期表的规律:
①元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
②同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
③同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
初中化学知识点:元素的定义
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
◎ 元素的定义的知识扩展
元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
原子核外电子数(质子数)决定了元素的种类。◎ 元素的定义的知识对比
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
初中化学知识点:同素异形体
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
同素异形体的知识扩展
a)定义:同素异形体,是相同元素组成,不同形态的单质。
如:碳元素就有金刚石、石墨、无定形碳等同素异形体。
b)性质:同素异形体由于结构不同,彼此间物理性质有差异;
但由于是同种元素形成的单质,所以化学性质相似。◎ 同素异形体的知识点拨
注意事项:
由于构成物质的原子(或分子)的排列不同,或原子的成键、排列方式不同,使得同一种元素产生多种单质。各种同素异形体都是不同的物质,具有不同的物理性质,但化学性质不一定不同。
初中化学常见的同素异形体:
氧气,臭氧,金刚石,碳,石墨,红磷,白磷
1.对比碳和氧的同素异形体的结构,概述同素异形体的成因。
答案
可能是由于分子中原子个数不同,也可能是原子间的成键方式不同或者原子的排列方式不同,导致有些元素存在同素异形体。
2.同素异形体之间物理性质和化学性质是否相同?
答案
同素异形体的物理性质不同,化学性质相似。
初中化学元素基础知识相关文章:
